Девять значимых событий 2022 года в биологии и медицине
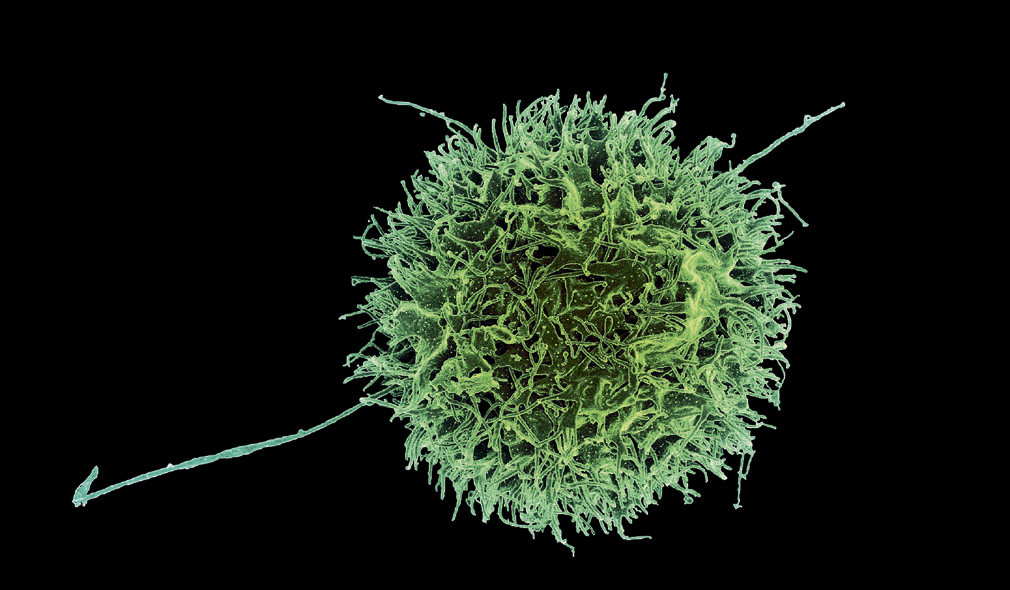
1В клеточный атлас добавили полмиллиона новых клеток
Биология и медицина не избежали общего стремления к накоплению больших данных — в 2022 году клеточный атлас человека пополнился почти полумиллионом новых клеток. Переписью человеческих клеток занимается международный научный консорциум, который так и называется — Human Cell Atlas (HCA), то есть Атлас клеток человека. Он возник в 2016 году и сейчас объединяет более 2300 исследователей из 83 стран. Несколько лет назад HCA уже публиковал первые результаты с информацией более чем о полумиллионе клеток, а результаты новых исследований описаны в нескольких статьях, опубликованных в прошлом году в журнале «Science». В чём смысл такой работы?
Для атласа клетки изучают в прямом смысле поштучно: берут одну-единственную клетку и анализируют в ней активность генов, а именно, читают РНК, которая в этой клетке есть (информация с ДНК сначала копируется в РНК, и активность гена можно оценить по количеству таких копий).
Все наши клетки несут одни и те же гены, но мышечная клетка не похожа на клетку поджелудочной железы, синтезирующую инсулин, а нейрон не похож на Т-лимфоцит. Из множества генетических программ клетки работает та, которая нужна в конкретном органе и конкретной ткани.
Долгое время особенности разных клеток изучали по тканям: есть нервная ткань, есть мышечная, есть соединительная и т. д. Но орган — это более сложная вещь, в каждом органе есть представители разных тканей. И вот тут возникает вопрос, насколько клетки, которые принадлежат одной и той же ткани, отличаются в зависимости от того, в каком органе они сидят. Например, фибробласты соединительной ткани лёгких и фибробласты соединительной ткани кожи — одинаково ли они работают, отличается ли в них активность генов? Именно такие отличия и ищут составители клеточных атласов. Строго говоря, их цель не в том, чтобы описать буквально каждую клетку в каждом органе, — в этом нет смысла, поскольку органы состоят не из уникальных клеток, а из клеточных групп, принад-лежащих разным тканям. Но у клеток одной и той же ткани в разных органах будут свои особенности. И эти особенности можно увидеть в том, какие гены в них активны, а какие нет.
Возьмём, к примеру, те же фибробласты. Новые данные говорят о том, что в лёгочных фибробластах работают гены, которые обычно активны в мышечных клетках. Это не значит, что клетки соединительной ткани вдруг становятся мышечными и начинают сокращаться, но, так или иначе, им в лёгких зачем-то нужны некоторые молекулярные инструменты из мышечного арсенала. Другой пример — иммунные макрофаги, которые блуждают по тканям и в прямом смысле слова съедают всё подозрительное. Их, как оказалось, есть две группы: макрофаги сугубо иммунные, нацеленные на патогены, и макрофаги, которые поддерживают ткань в её повседневной работе, убирают разный мусор. Причём в каждой ткани доля тех и других макрофагов разная, в зависимости от того, чем эта ткань занимается.
Во многом неожиданные результаты касаются так называемых генов домашнего хозяйства — то есть таких генов, которые необходимы для базовых жизненных функций и активны в любых клетках. Оказалось, что, несмотря на свою «базовость», гены домашнего хозяйства в разных клетках работают по-разному.
Многие заболевания связаны с тем, что какой-то ген или группа генов перестают работать или, наоборот, начинают работать слишком активно. И здесь всё зависит от того, в каких клетках возникают генетические аномалии. Например, если речь о мерцательной аритмии, то неполадки с генами должны быть в клетках сердца — это очевидно. Однако в новом клеточном атласе есть данные о неожиданной активности генов, связанных с болезнями, в нехарактерных для них клетках. Те же гены мерцательной аритмии зачем-то нужны клеткам скелетных мышц, пищевода и предстательной железы. Какую роль они там играют, могут ли спровоцировать какую-нибудь патологию, и имеют ли сердечные гены, работающие в пищеводе, какое-то отношение к сердцу, пока неясно. Но так или иначе с помощью клеточного атласа удалось найти новые клетки для шести тысяч «одногенных» заболеваний и для двух тысяч сложных генетических расстройств. (Хотя, повторим ещё раз, что вовсе не обязательно новонайденные клетки играют какую-то роль в этих болезнях.)
Подобные исследования — характерная примета современной науки, которая может позволить себе подсчитывать клетки и молекулы поштучно. Кроме проекта HCA, есть другие, посвящённые человеческому мозгу или отдельным видам рака, или даже отдельным типам клеток в пределах опухоли одного вида.
2Человеческий геном дочитали до конца
Проект «Геном человека» начался в 1990 году, а о его окончании объявили в 2003-м. Правда, потом исследователи ещё какое-то время уточняли прочитанные генетические последовательности, так что точный человеческий геном был опубликован в 2004 году. Но на самом деле тогда за кадром осталось около 8% ДНК, по большей части представленной многочисленными повторами более или менее длинных последовательностей.
В любой хромосоме есть обширные зоны повторов — это теломеры и центромеры. Теломерами называют концевые участки хромосом, они ничего не кодируют, но зато защищают кодирующие участки от повреждений при копировании ДНК. Копировальный аппарат клетки устроен так, что не может дочитывать хромосомную ДНК до самого конца, какой-то кусочек на конце обязательно теряется. И вот бессмысленные теломеры как раз постепенно отдают себя кусок за куском при копировании ДНК. Центромеры же нужны для другого — к ним крепятся белки, которые растаскивают хромосомы при делении клетки к её полюсам, чтобы каждой дочерней клетке досталась нормальная полноценная копия родительского генома. Центромеры находятся примерно посередине хромосомы, хотя в некоторых случаях они делят хромосому на две очень неравные части.
Теломерные и центромерные участки с повторами изначально пропускали не просто так. Взять и прочесть всю хромосому как она есть, от начала до конца, невозможно — существующие методы позволяют читать ДНК лишь определённой длины, намного меньшей длины целой хромосомы. Поэтому огромную хромосомную ДНК дробят на части, эти части читают, а потом получившиеся последовательности соединяют вместе. Но не будем забывать, что весь алфавит ДНК — это всего четыре буквы, четыре нуклеотида: А, Т, Г, Ц. Можно догадаться, насколько непростыми должны быть алгоритмы, которые ищут, где перекрываются разные куски ДНК, где соединяются конец одного фрагмента и начало другого. Задача тем труднее, чем меньше фрагмент, потому что тем сложнее понять, в каком контексте он стоит в геноме. (Для сравнения: можно представить, что вам нужно определить, откуда в незнакомом вам романе взят абзац, или предложение, или всего лишь словосочетание, например «голубое небо» — это голубое небо может стоять в тексте в нескольких местах.) И задача ещё более усложняется, если мы имеем дело с фрагментами, составленными из повторов.
Но если научиться читать достаточно длинные куски ДНК, то можно просеквенировать и зоны с повторами. Собственно, в этом направлении методы чтения ДНК и развивались — фрагменты ДНК, которые можно прочесть за раз, постоянно удлинялись. Кроме того, совершенствовались алгоритмы и сама вычислительная техника, которую биоинформатики используют для сборки геномов. Постепенно центромеры и теломеры дочитывались, и вот в прошлом году в журналах «Science» и «Nature Methods» вышло сразу несколько статей, которые закрывают последние белые пятна на карте человеческого генома.
Оказалось, что у центромер структура довольно сложная: они состоят из крупных повторов, которые, в свою очередь, образованы повторами поменьше, причём рисунок повторов в центромерах у каждой хромосомы свой. Это тем более интересно, если учесть, что центромеры, в общем-то, выполняют у всех хромосом одну и ту же работу.
Кроме теломерных и центромерных участков, исследователи прочитали и другие неразведанные участки генома, в которых оказалось порядочно генов — целых 3604. Правда, большая часть их — это копии уже изученных генов, может быть, слегка отличающиеся от известных вариантов. Однако нашлись и такие, которые кодируют какие-то новые белки, в том смысле, что в прежних вариантах человеческого генома их не было. Таких абсолютно новых генов оказалось 104. Новооткрытые гены (все 3604) имеют отношение к развитию мозга и организма в целом, некоторые связаны с сердечно-сосудистыми, онкологическими и иммунными заболеваниями. Но, прежде чем судить о них с генетико-медицинской точки зрения, нужно проверить, насколько они вообще активны (про некоторые гены сразу стало понятно, что они домутировались до нерабочего состояния).
Ещё бóльшая работа предстоит, чтобы превратить эти участки в референсную ДНК. Дело в том, что для того, чтобы получить настоящий человеческий геном, нужно сопоставить много геномов от разных людей. В нашей ДНК есть последовательности, которые неизменны у всех, и есть другие последовательности, которые могут отличаться если не у каждого человека, то у очень многих. Сравнивая геномы разных людей, получают так называемый референсный геном — он относится не к конкретному человеку, но к людям вообще. Именно на референсный геном смотрят специалисты по медицинской генетике, когда ищут опасные мутации в геноме конкретного пациента. Бóльшая часть генома сейчас уже вполне референсная. Но вот те центромеры, теломеры и другие последовательности, о которых сейчас шла речь, — их читали в ДНК, взятой из клеток, которые образовались при аномальной неудавшейся беременности. (Кроме того, белые пятна Y-хромосомы закрыли с помощью одного профессора из Гарварда, который любезно предоставил свой генетический материал для исследований.) Проще говоря, для «референсизации» центромер и теломер нужны новые геномные данные от самых разных людей. Впрочем, частично новые последовательности уже сверяли с данными, полученными при секвенировании человеческой ДНК в рамках других геномных проектов. Таким образом удалось установить, в каких участках прежних белых пятен следует ожидать наиболее сильные индивидуальные вариации. Когда придёт время собирать новый референсный геном человека — что, по-видимому, дело ближайшего будущего, — именно на эти особо вариативные участки будут обращать специальное внимание.
3Генетический редактор стал в четыре тысячи раз точнее
Научившись читать геном, можно подумать и о том, чтобы научиться его изменять. Плюсы редактирования генома и перечислять не стоит, достаточно подумать о болезнетворных мутациях, которые можно стереть из ДНК с помощью молекулярного редактора. Таких редакторов придумано несколько, но самый многообещающий — это CRISPR-Cas9. В 2020 году за него дали Нобелевскую премию по химии, и тогда мы подробно рассказывали, как он устроен («Редактор для генома», «Наука и жизнь» № 12, 2020 г.). В сравнении с другими методами редактирования он проще, с его помощью можно внести правки в такие участки ДНК, которые недоступны другим редакторам, и ещё он точнее, чем другие, то есть вносит правки только туда, куда нужно, без непредсказуемой самодеятельности. Впрочем, точность его всё-таки относительна, и это одна из причин, по которой CRISPR-Cas9 остерегаются широко внедрять в клиническую практику. Более того, некоторые исследователи полагают, что именно в человеческом геноме CRISPR-Cas9 позволяет себе особенно много лишнего.
